Новые возможности для диагностики,терапии и оценки рисков
Автор-составитель
канд. биол. наук В.В.Вельков
ЧТО ТАКОЕ ГЛИКОЗИЛИРОВАННЫЙ ГЕМОГЛОБИН?
Белки, в том числе и гемоглобин, если их долго выдерживать в растворе, содержащем глюкозу, связываются с ней и, что принципиально, такое связывание происходит самопроизвольно – не энзиматически. Гликозилированный (или гликированный) гемоглобин (далее – HbA1c) образуется в результате такой медленной, неферментативной (неэнзиматической) реакции между гемоглобином А, содержащемся в эритроцитах, и глюкозой сыворотки крови.
Скорость гликозилирования гемоглобина (а следовательно, его концентрация) определяется средним уровнем глюкозы, который существует на протяжении жизни эритроцита. Эритроциты, циркулирующие в крови, имеют разный возраст, поэтому для усредненной характеристики уровня связанной с ними глюкозы ориентируются на полупериод жизни эритроцитов – 60 суток. Есть, по крайней мере, три варианта гликозилированных гемоглобинов: НbA1a, HbA1b, HbA1c, но только вариант HbA1c количественно преобладает и дает более тесную корреляцию со степенью выраженности сахарного диабета. Повышение концентрации глюкозы в крови значительно увеличивает ее поступление в клетки за счет инсулиннезависимых механизмов. В результате глюкоза поступает в ткани в избытке и при этом неферментативно гликозилируются следующие белки: 1) гемоглобин; 2) белки мембран эритроцитов; 3) альбумин; 4) трансферрин; 5) аполипопротеины; 6) коллаген; 7) белки эндотелия; 8) белки хрусталика; 9) некоторые ферменты (алкогольдегидрогеназа) и ряд других белков. Гликозилирование – медленная реакция; в тканях здоровых людей обнаруживаются лишь небольшие количества гликозилированных белков, но у больных диабетом именно высокий уровень гликозилирования белков приводит к серьезным осложнениям. Степень гликозилирования разных белков неодинакова и в каждом случае зависит не столько от степени повышения концентрации глюкозы, сколько от времени жизни конкретного белка, т.е. от скорости его обновления. В медленно обменивающихся («долгоживущих») белках накапливается больше модифицированных аминогрупп, в короткоживущих – меньше.
Естественно, что при присоединении глюкозы функции белка могут нарушаться из-за изменения заряда белковой молекулы, из-за нарушения ее конформации или из-за блокирования активного центра. Это и приводит к многочисленным осложнениям диабета. От того, какие именно белки и в какой степени гликозилированы и зависит, какие именно осложнения возникнут и насколько тяжелыми они будут. Кажется весьма перспективным, при гипергликемиях следовало бы измерять концентрации большого набора конкретных гликозилированных белков и, тем самым, оценивать степень риска возникновения и скорости развития соответствующих осложнений диабета. Однако такой специфический подход, пригодный для рутинной оценки индивидуальных рисков различных осложнений диабета, – дело будущего. В данный момент для обобщенных оценок таких рисков применяется измерение обобщенного показателя гипергликемии – концентрации HbA1c, но подробнее об этом – позже.
ПОЧЕМУ ИЗМЕРЕНИЕ ГЛЮКОЗЫ В КРОВИ НЕДОСТАТОЧНО ДЛЯ ЭФФЕКТИВНОЙ ДИАГНОСТИКИ ДИАБЕТА И МОНИТОРИНГА ЕГО ТЕРАПИИ?
Наглядный ответ на этот вопрос представлен на рис. 3. Какой вывод о реальной компенсации диабета можно сделать, если измерение концентрации глюкозы в крови состоялось, например, в момент ее максимума? Или в момент ее минимума?
Действительно, измерение глюкозы в крови оценивает текущий (сиюминутный) уровень глюкозы, который может зависеть: 1) от приема (или неприема) пищи; 2) от ее состава, 3) от физических нагрузок и их интенсивности, 4) от эмоционального состояния пациента, 5) от времени суток и даже 6) от погодных условий. Очевидна высокая вероятность того, что определение текущего уровня глюкозы в крови не будет отражать действительную степень компенсации сахарного диабета, а это может привести либо к передозировке лечебных препаратов, либо к неоправданному уменьшению их количества. Ценность определения гликозилированного гемоглобина (HbA1c) в том, что он характеризует, как уже говорилось, средний уровень глюкозы в крови на протяжении длительного промежутка времени, то есть действительную степень компенсации сахарного диабета на протяжении последних 1–2 месяцев.
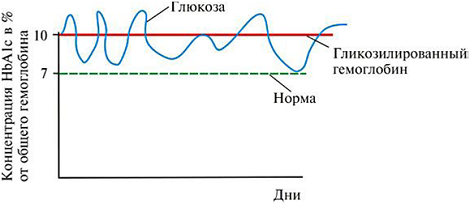
Рис. 3. Динамика концентрации глюкозы в крови на протяжении 9 недель.
Концентрация глюкозы изменяется между 7 и 12 ммоль/л. Уровень HbA1c в течение всего периода постоянен – 10%.
Ранее для выявления сахарного диабета (далее – СД), как и для контроля степени его компенсации, рекомендовалось определение содержания глюкозы в крови натощак и перед каждым приемом пищи. Затем было установлено, что более четкая корреляция между уровнем глюкозы в крови, наличием сосудистых осложнений диабета и степенью их прогрессирования выявляется не показателями гликемии натощак, а степенью ее увеличения в период после приема пищи – постпрандиальная гипергликемия. Весьма существенно, что с ростом в мире заболеваемости диабетом показатели нормальных концентраций глюкозы постоянно снижались (см. табл. 1).
Таблица 1
Изменение критериев СД с 1993 по 2000 г.
|
Период |
Глюкоза натощак |
Постпрандиальная глюкоза |
|
|
До 1993 г. |
200 мг% |
9 — 10 |
|
|
После DCCT |
140 мг% |
150% |
8 |
|
1997 г. |
80-120 %мг% |
90 — 130% |
<7 |
|
2000 г. |
£99 мг% |
£109% |
<6 |
*DCCT – крупный исследовательский проект – Diabetes Control and Complications Trial.
Полагается, что критерии диагностики СД и уровней его компенсации, соответствующие рекомендациям ВОЗ (2002 г.), необходимо и дальше «ужесточать». Это обусловлено исследованиями последних лет, которые показали, что частота, времяразвития поздних сосудистых осложнений СД и скорость их прогрессирования имеют прямую корреляцию со степенью компенсации СД, о которой уверенно можно судить только на основании измерений уровней HbA1c. Уровень HbA1с свидетельствует одновременно об уровне глюкозы натощак, о препрандиальном и постпрандиальном ее уровнях. В целом, определение НbА1с дает усредненное, интегрированное представление об уровне гликемии при всех формах диабета.
Но этим ценность измерения НbА1с отнюдь не исчерпывается. НbА1с – это не только диагностический показатель, но и весьма достоверный предиктор целого спектра осложнений, как микрососудистых, так и макрососудистых. И чем лучше скомпенсирован диабет, о чем уверенно свидетельствовать может только уровень НbА1с, тем меньше риск развития таких осложнений диабета, как поражение глаз – ретинопатия, поражение почек – нефропатия, поражение периферических нервов и сосудов, ведущее к гангрене. В целом, уровень HbA1c показывает: 1) какой была концентрация глюкозы в предшествующие 4–8 недель, 2) какой была степень компенсации углеводного обмена на протяжении этого периода, 3) каков на данный момент риск развития осложнений диабета.
Таким образом, стратегическая цель лечения СД – постоянное поддержание глюкозы в пределах нормы и тем самым предотвращение развития диабетических осложнений – может быть достигнута лишь при сочетанном определении как глюкозы в крови, так и концентрации HbA1c. Образно говоря, при терапии сахарного диабета «понижать» надо не глюкозу в крови, а гликозилированный гемоглобин!
Или, строго говоря, при лечении диабета ориентироваться следует не на уровни глюкозы натощак, а на уровни HbA1c.
ГЛИКОЗИЛИРОВАННЫЙ ГЕМОГЛОБИН – ПРЕДИКТОР ОСЛОЖНЕНИЙ САХАРНОГО ДИАБЕТА
Большинство пациентов с СД умирают от сердечно-сосудистых осложнений. Диабетики в 4 раза чаще страдают ишемической болезнью сердца, чем пациенты без диабета (того же возраста), и в 2–3 раза чаще подвержены инсультам. Через 9 лет после постановки диагноза СД второго типа (далее СД II) у каждого пятого пациента развиваются макрососудистые осложнения, а у каждого десятого – микрососудистые.
Более половины больных СД умирают от сердечно-сосудистых заболеваний. Даже сегодня СД все еще остается главной причиной слепоты и терминальных стадий почечных заболеваний. Нейропатии, вызванные диабетом, – основная причина нетравматических ампутаций конечностей (отметим, что гангрены развиваются не столько от нейропатии, сколько от сосудистых осложнений). В последние годы СД II становится главной причиной сердечно-сосудистых заболеваний. Широкомасштабные проспективные исследования четко показали: у лиц, страдающих диабетом второго типа, имеется четкая связь между уровнем гипергликемии и повышенным рисками как микрососудистых, так и макрососудистых осложнений (рис. 4). В популяции среди всех диабетических осложнений ретинопатии составляют 49%; нейропатии – 40%; нефропатии – 35%, сердечно-сосудистые заболевания – 43% (рис. 5).
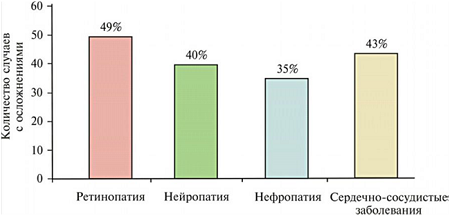
Рис. 4. Основные типы рисков осложнений сахарных диабетов
Но можно ли оценить риск диабетических осложнений не в популяции лиц, страдающих диабетом, а у конкретного пациента?
HbA1c – ПРЕДИКТОР ОБЩЕЙ СМЕРТНОСТИ
В одном из недавних широкомасштабных исследований было изучено 3 642 пациента, страдающих СД. Оказалось, что практически все осложнения диабета были связаны с гипергликемией. Снижение уровня HbA1с на 1% было связано с уменьшением этих рисков на 21%. В частности, при снижении HbA1с на 1% смертность от диабета снижалась на 15–27%, смертность от инфарктов – на 8–21% и смертность от микроваскулярных осложнений – на 34–41%. Показательно, что зависимость этих рисков от уровней HbA1с имела плавный характер, пороговых значений концентрации HbA1с по отношению к указанным рискам замечено не было. В частности, не обнаружено пороговых значений HbA1с после которых резко возрастают риски прогрессирующей ретинопатии, повышенной секреции альбумина в моче, резкого утяжеления нефропатии. Нет и пороговых значений HbcA1, после которых резко повышается риск смерти от макроваскулярных заболеваний, …Беда подступает постепенно. Существенно, что связь между повышенными уровнями HbcA1 и указанными рисками является достоверной и после поправки на такие традиционныефакторы риска, как возраст, пол, систолическое кровяное давление, концентрации липидов, курение и альбуминурия. В целом, у мужчин и женщин в возрасте от 45 до 79 лет повышение уровня HbA1c на 1% связано с повышением риска общей смертности на 20–30%. Причем эта закономерность не зависела от наличия диабета.
Более того, показано (с учетом поправки на другие факторы риска), что HbA1c – это также предиктор общей смертности пациентов с недиабетическими заболеваниями почек. Очевидно, что измерение уровней HbA1c может быть важным для стратификации популяции, согласно риску общей смертности. Такой вывод подтвердился и в недавнем исследовании 3710 японцев, выживших после атомной бомбардировки. Согласно уровням их HbA1c, эти лица были разделены на следующие группы:
1) нормальный уровень HbA1с – от 5 до <6,0% (1 143 человека); 2) слегка повышенный, но все еще нормальный уровень HbA1c – от 5,5 до 6,0% (1 341 человек), 3) умеренно высокий уровень HbA1c – от 6,0 до <6,5% (589 человек), 4) высокий уровень HbA1c – от 6,5% (259 человек), 5) страдающие диабетом второго типа (378 человек). В течение наблюдений умерло 754 человека. Повышенный риск общей смертности и смертности от сердечно-сосудистых заболеваний наблюдался в группе со слегка высоким уровнем HbA1с – от 6,0 до 6,5%. Повышенная смертность от злокачественных опухолей была обнаружена в группе с высоким уровнем HbA1c – от 6,5% и у лиц, страдающих диабетом второго типа. Сделан вывод, что при уровнях HbA1c от 6% и выше повышается риск смертности. Полагается, что измерение концентрации HbA1c для оценки риска общей смертности должно проводиться также и у лиц, не страдающих диабетом.
HbA1c – ПРЕДИКТОР ФАТАЛЬНЫХ И НЕФАТАЛЬНЫХ ИНФАРКТОВ МИОКАРДА
Оказывается, что повышенные уровни HbAlc предсказывают сердечно-сосудистые риски у лиц, как страдающих диабетом, так и не имеющих его (рис. 6). Хотя, разумеется, у лиц, страдающих диабетом, эти риски значительно выше, чем у недиабетиков. Особо следует подчеркнуть, что повышение рисков инфарктов начинается уже с концентраций HbAlc, которые обычно считаются нормальными – 5,5%.
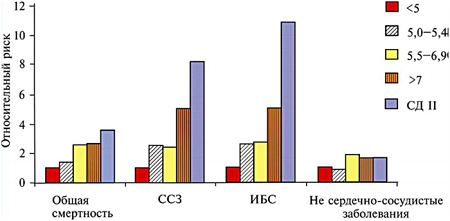
Рис. 6. Относительные риски смертности от сердечно-сосудистых заболеваний в зависимости от повышенных уровней HbAlc. (ССЗ – сердечно-сосудистые заболевания, ИБС – ишемическая болезнь сердца)
Причина этого пока не ясна. Что же касается рисков микрососудистых осложнений, то при достижении значений HbAlc выше 9% они возрастают быстрее, чем сердечно-сосудистые риски (рис. 7).
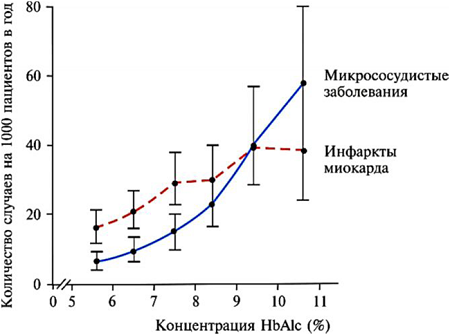
Рис. 7. Связь инфарктов миокарда и микрососудистых заболеваний с уровнями HbAlc
В общем, повышение уровня HbA1с на 1% связано с повышением риска фатальных и нефатальных инфарктов на 14% (рис. 8).
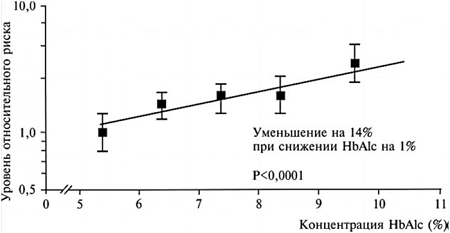
Рис. 8. Зависимость риска фатальных и нефатальных инфарктов миокарда от уровней HbA1с
В 2004 г. были обобщены результаты 10 различных исследований (мета-анализ), в которых представлены данные историй болезни около 7 500 лиц с СД II. Было выявлено, что повышение HbA1c на 1% связано с повышением риска сердечных приступов или инсультов на 18%. Однако риск заболеваний периферических сосудов при повышении уровня HbA1c на 1% повышался на 28%. Аналогичные результаты были получены и при исследовании лиц с СД I типа, но эти данные оказались статистически недостоверны. В целом, данные о связи между повышенными уровнями глюкозы в крови и сердечно- сосудистыми рисками находят все большее подтверждение. Существенно, что такаясвязь наблюдается даже при тех уровнях глюкозы, которые ниже критических значений, при которых принято диагностировать диабет.
В недавнем исследовании (2004 г.) изучалась связь между уровнем HbA1c и частотой сердечно-сосудистых событий в течение 6 лет у 4 662 мужчин и 5 570 женщин (возраст 45–79 лет), как страдающих, так и не страдающих диабетом. За эти 6 лет зарегистрировано 806 сердечно-сосудистых событий и 521 летальный исход. У мужчин повышение уровня HbA1c на 1% связано с увеличением риска сердечно-сосудистых событий на 21% и риска общей смертности – на 22% и на 28% у женщин (после поправки на традиционные факторы сердечно-сосудистого риска). В отличие от уровня HbA1c наличие диабета не являлось достоверным предиктором сердечно-сосудистых событий или смерти. Даже после исключения из анализа больных с уровнем HbA1c не ниже 7% или лиц с уже имеющейся сердечно-сосудистой патологией увеличение уровня HbA1c на 1% сочеталось с повышением риска ишемической болезни сердца на 40%, сердечно-сосудистых событий – на 16%, риска общей смертности – на 26%. Согласно устоявшимся представлениям об атеросклерозе, одна из ведущих причин его возникновения и развития – патологические изменения метаболизма холестеринов, связанных с липопротеинами низкой и высокой плотности, и триглицеридов. Поэтому вопрос, есть ли связь между уровнями HbA1c и концентрациями холестеринов, связанных с липидами низкой и высокой плотности, весьма закономерен. Ответ, который был на него получен, впечатляет.
HbA1c И АТЕРОСКЛЕРОЗ
Изучалось 2 060 лиц с диабетом. Определялась корреляция между уровнями HbA1c, сердечно-сосудистыми заболеваниями (ССЗ), толщиной интима / медиа сонной артерии и традиционными кардиорисками. Оказалось, изменения концентраций Х-ЛПНП и Х-ЛПВП и триглицеридов действительно тесно связаны с изменениями HbA1c.Обнаружена также связь между увеличением толщины интима / медиа и уровнями HbA1c. После поправки на традиционные факторы кардиорисков стало ясным, что связь между изменениями концентраций HbA1c и указанными показателями рисков сердечно-сосудистых заболеваний имеет линейный характер. Принципиально, что кардиориски начинают возрастать даже при концентрациях HbA1c, меньших, чем 7%, а именно этот уровень HbA1c считается нормальным при терапии гликемий. Однако для лиц, не страдающих диабетом, зависимость между уровнями HbA1c и кардиорисками оказалась более сложной. При уровнях HbA1c ниже 4,6% четкой корреляции между HbA1c и кардиорисками нет. Но уже при уровне 4,6% и выше наблюдается повышение кардиорисков даже после поправки на другие факторы риска ССЗ. Авторы делают парадоксальный вывод: у лиц, не страдающих диабетом, так называемые «нормальные» уровни HbA1c (находящиеся между 4,6 и 6,0%) связаны с рисками сердечно-сосудистых заболеваний. Означает ли это, что для лиц, не страдающих диабетом, «нормальные значения» концентрации HbA1c должны находиться ниже 4,6%? Ответа пока нет. Таким образом, HbA1c – это независимый фактор риска сердечно-сосудистых заболеваний у лиц с диагностированным или недиагностированным диабетом. Следовательно, тест на HbA1c должен быть добавлен к тестам, оценивающим сердечно-сосудистые риски. Однако повышенные уровни HbA1c – это не только указание на повышенный риска ССЗ, но и показатель, позволяющий судить о количестве коронарных сосудов, пораженных стенозом. У больных СД II, страдающих сердечной болью, проводили ангиографию и одновременно определяли уровни HbA1c. Оказалось, что при Hb A1c – 6,68% стенозы в сосудах не обнаруживались, при Hb A1c – 8,0% поражен один сосуд, при Hb A1c – 8,83% – два сосуда, а при Hb A1c – 10,40% стенозом были поражены 3–4 сосуда. Авторы делают вывод: «Чем выше уровень HbA1c – тем больше поврежденных коронарных сосудов». Действительно, атеросклероз – первая причина смертности от диабета второго типа, риск развития сердечно-сосудистых заболеваний у диабетиков в 2 – 4 раза выше, чем у недиабетиков. Каким образом гипергликемия приводит к атеросклерозу? Одна из главных причин атеросклероза – повышенные уровни Х-ЛПНП. Тогда закономерно ожидать, что уровень Х-ЛПНП в плазме диабетиков будет выше, чем у недиабетиков. Увы, это не так. В реальности, концентрации Х-ЛПНП в плазме диабетиков такие же, как в норме. Тем не менее, терапия статинами, снижающими уровень холестерина, снижала у таких больных сердечно-сосудистые риски даже в тех случаях, когда уровни холестерина были нормальными и/или когда у таких пациентов не было предшествующих сердечно-сосудистых событий. Можно ли попытаться объяснить этот парадокс? Как уже говорилось, неэнзиматическому гликозилированию могут подвергаться любые белки. И аполипопротеин В – основной белок «атерогенного» Х-ЛПНП в том числе? Именно так. Действительно, оказалось, что Апо В у лиц, страдающих диабетом 2 типа, гликозилирован в большей степени, чем у недиабетиков. Более того, частицы Х-ЛПНП, выделенные из плазмы диабетиков, оказались более чувствительны к окислению, что значительно повышало их атерогенный потенциал. Уже давно было известно, что гликозилирование Х-ЛПНП значительно замедляет скорость катаболизма этих крайне атерогенных частиц. Отметим, что при повышенной концентрации глюкозы гликозилируется большое количество и других белков, как свободно циркулирующих в крови, так и связанных с различными компонентами сосудистой системы. Такие гликозилированные белки могут приводить к широкому спектру различных патологий, и можно надеяться, что в будущем будут разработаны методы определения конкретных гликозилированных белков и будет установлена их связь с различными типами патологий. Гликозилированные гемоглобин и Х-ЛПНП – это только «верхушка айсберга», образованного избыточными концентрациями глюкозы в крови.
В общем, у диабетиков Апо В-100 гликозилирован в два раза интенсивнее, чем у недиабетиков, и, таким образом, гипергликемия связана с повышенным гликозилированием Х-ЛПНП и повышенной интенсивностью его окисления, что делает Х-ЛПНП более атерогенным. Однако повышенные уровни HbA1с связаны не только с повышением атерогенности Х-ЛПНП. Показано, что повышение HbA1с и продолжительность диабета положительно связаны с повышенными триглицеридами, что согласуется с тем, что больные с нарушенной регуляцией уровня глюкозы имеют также и высокий уровень триглицеридов – феномен, который часто связан с инсулинрезистентностью. Итак, повышенные концентрации HbA1с – это также указание: 1) на высокую вероятность того, что у пациента высокий уровень гликозилированного Х-ЛПНП, подверженного интенсивному окислению и поэтому более атерогенного, и 2) на высокие уровни триглицеридов.
ГЛИКОЗИЛИРОВАННЫЙ ГЕМОГЛОБИН –ПРЕДИКТОР ИШЕМИЧЕСКИХ ИНСУЛЬТОВ
То, что у лиц, страдающих диабетом, повышен риск ишемических инсультов – факт хорошо известный. Действительно, недавно была убедительно показана связь между инсультами и уровнями HbA1c у лиц, страдающих СД II. Оказалось, что у лиц, у которых произошли фатальные инсульты, HbA1c был более высокий, чем у тех, кто пережил инсульт. Является ли их причиной длительная гипергликемия? Есть ли связь между уровнями HbA1c и уровнями риска инсультов? Для ответа на эти вопросы концентрации HbA1c измеряли у 167 лиц, перенесших инсульт, у 680 лиц, не имевших инсульта и диабета, и у 1 635 лиц, страдавших диабетов, 89 из которых перенесли инсульт. Была обнаружена четкая взаимосвязь между повышенными уровнями HbA1c и повышенными рисками инсультов в последующие 8–10 лет. Авторы убеждены, что хронически повышенная гликемия может принимать участие в возникновении и развитии инсультов как у лиц, страдающих диабетом, так и у лиц, его не имеющих. Разумеется, у диабетиков риск инсультов гораздо выше, чем у тех, кто диабета не имеет. Наибольший риск имеют лица, у которых HbA1c выше 6,8%, что в 4 раза превышает риск инсультов у лиц без диабета, у которых уровни HbA1с ниже 4,7%. Существенно, что данное повышение рисков инсультов сходно с повышением риска сердечно-сосудистых событий у лиц с повышенными концентрациями HbA1с. Особо отметим, что при повышении уровней HbA1с и соответствующими повышениями кардиорисков и рисков инсультов пограничных значений концентраций HbA1с, которые бы отделяли риски, связанные с диабетом, от рисков, с диабетом не связанных, обнаружено не было. По мнению авторов, взаимосвязь между повышенными кардиорисками и повышенным HbA1с обусловлена скорее гликемическим статусом, нежели диагностированным диабетом как таковым.
В целом, риск ишемических инсультов возрастает с повышением концентрации HbA1с как у лиц, страдающих диабетом, так и у недиабетиков: у лиц, страдающих диабетом, риск инсультов в 4 раза выше, чем у недиабетиков.
Следовательно повышенный уровень HbA1с – это независимый фактор риска инсульта как у лиц, страдающих диабетом, так и у недиабетиков.
HbA1c – ПРЕДИКТОР ОСЛОЖНЕНИЙ ПЕРИФЕРИЧЕСКОЙ СОСУДИСТОЙ СИСТЕМЫ
Гликозилированный гемоглобин не просто метаболически нейтральный индикатор уровня гипергликемии. В результате гликозилирования гемоглобин превращается в причину весьма опасных патологий. Обладая повышенным сродством к кислороду, HbA1c вызывает снижение поступления кислорода в ткани. В итоге происходят: 1) гипоксия периферических тканей, 2) частичное шунтирование кровотока и 3) нарушение метаболизма в различных тканях. Но гликозилируется, как уже говорилось, не только гемоглобин.
Гликированный альбумин имеет нарушенную способность транспортировать билирубин, жирные кислоты, некоторые лекарственные препараты, в т.ч. и гипогликемические пероральные препараты. Также происходит накопление гликозилированного альбумина в базальных мембранах капилляров – причем степень накопления гликозилированного альбумина в базальных мембранах пропорциональна степени его гликозилирования и, следовательно, тяжести гипергликемии. Особое сродство имеет гликозилированный альбумин к капиллярам почечных клубочков.
Гликозилирование коллагена ведет в итоге, к гликозилированию базальных мембран, что снижает трансмембранный транспорт. Наиболее опасным является гликозилирование мембран клубочков почек. Гликозилированный коллаген приобретает способность связываться с гликозилированным и негликозилированным альбумином и с иммуноглобулином G, что вызывает избыточное образование иммунных комплексов. Присоединение альбумина повышает толщину базальных мембран, а иммуноглобулин образует повреждающий мембрану комплементный комплекс. Более того, повышение уровня гликозилированного коллагена ведет к уменьшению его растворимости и эластичности, а также к снижению его чувствительности к протеолитическим ферментам. Это вызывает преждевременное старение и нарушение функции соответствующей ткани или органа, стимулирует образование контрактур, часто сопутствующих сахарному диабету. В целом, при сахарном диабете гликозилированию подвергаются практически все белки и в результате:
- гликозилированный гемоглобин приобретает повышенное сродство к кислороду, что ведет к гипоксии периферических тканей;
- гликозилированные белки хрусталика ведут к нарушению светопропускания;
- гликозилирование миелина ведет к нарушению проведения импульсов по нервным волокнам и к развитию нейропатии;
- гликозилированные белки базальных мембран вызывают нарушения почечной фильтрации и, в итоге, нефропатию почечных клубочков;
- гликозилированный коллаген повреждает строму органов и тканей, нарушает транскапиллярный обмен, ведет к нарушению гидратации соединительной ткани («морщинистая кожа»);
- гликозилированные белки коронарных сосудов нарушают кровоснабжение миокарда;
- гликозилированный альбумин ведет к нарушению транспортной функции, к патологии почечных клубочков;
- гликозирование аполипопротеина В приводит к атеросклерозу, ишемической болезни сердца, инфарктам и инсультам.
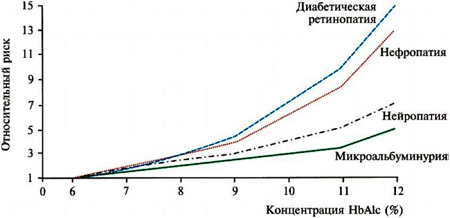
Повышенные уровни HbA1с предсказывают, по крайней мере, 4 типа микрососудистых осложнений (рис. 9).
Сравнительно недавно показано, в частности, что при СД II (изучено 3 834 лиц) повышение уровня HbA1c было весьма сильно связано с риском заболеваний периферической сосудистой системы и, что важно, независимо от таких факторов риска, как повышенное систолическое давление, пониженный уровень Х-ЛПВП, курение, предшествующие сердечно-сосудистые заболевания, дистальная нейропатия и ретинопатия. Повышение HbA1c на 1% было связано с повышением риска заболеваний периферической сосудистой системы на 28%. А согласно данным трех независимых широкомасштабных исследований, снижение концентрации HbA1c на 1% приводило к значительному снижению риска ретинопатий, нефропатий, нейропатий и сердечно-сосудистых заболеваний (табл. 2).
Таблица 2
Снижение рисков микрососудистых и макрососудистых осложнений диабета при снижении концентрации HbA1c на 1%
|
Исследование,% |
Ретинопатии,% |
Нефропатии,% |
Нейропатии,% |
ССЗ, % |
|
DCCT |
27 — 38 |
22 — 28 |
29 — 35 |
40 |
Особо подчеркнем, что диабетическая нефропатия – одна из основных причин развития хронической почечной недостаточности и, как следствия, смертности больных.
Микроальбуминурия – маркер ранней диагностики микроангиопатии при диабетической нефропатии. Исследование на микроальбуминурию позволяет выявлять обратимые патологические процессы в почечной паренхиме еще до развития клинических проявлений диабетической нефропатии. Диагностика диабетической нефропатии базируется, в первую очередь, на выявлении микроколичеств альбумина («микроальбумина»), обнаружение которого зависит как от длительности заболевания, так и от типа СД. У больных диабетом уровень микроальбумина может превышать норму в 10–100 раз. У лиц, страдающих СД I, обнаружить доклиническую стадию нефропатии можно, проводя мониторинг артериального давления и определяя экскрецию микроальбумина. Обычно уже на ранней стадии нефропатии при наличии только микроальбуминурии выявляется умеренное, но прогрессивно увеличивающееся артериальное давление. У больных СД I определение микроальбуминурии проводят ежегодно. У больных, страдающих СД II, определение микроальбуминурии проводят 1 раз в 3 месяца с момента диагностики заболевания. При появлении протеинурии мониторинг прогрессирования диабетической нефропатии включает определение скорости клубочковой фильтрации (проба Реберга) 1 раз в 5–6 месяцев, уровней креатинина и мочевины в сыворотке крови, экскреции белка с мочой, а также артериального давления. Весьма значимо, что «микроальбумин» отражает также риск развития сердечно-сосудистых осложнений при диабетах I и II типов.
HbA1c – ПРЕДИКТОР ПАТОЛОГИЙ БЕРЕМЕННОСТИ
Полная компенсация диабета имеет ключевое значение при решении вопроса о сохранении беременности. Важнейший показатель адекватной компенсации сахарного диабета – уровень HbA1c в крови беременных. Для нормального развития плода необходимо, чтобы этот показатель был менее 6,4%. Во многих исследованиях показано, что высокий уровень HbA1c в крови женщин в первом триместре беременности (когда происходит закладка внутренних органов плода) коррелирует с более высокой частотой врожденных дефектов развития у новорожденных (табл.3) и с более высокой частотой самопроизвольных абортов (рис. 10).
Действительно, еще в 1989 г. было сообщено о том, что в течение первого триместра беременности при уровнях HbA1c выше 12,7% риск спонтанных абортов и возникновения врожденных патологий плода достигает 39%. При уровнях HbA1c выше 8% риск серьезных врожденных патологий плода возрастает до 4,4%, что в два раза превышает среднее значение этого риска в целом по популяции [34]. Но, как затем оказалось, при более широкомасштабном исследовании беременных женщин с СД I, к повышенному риску врожденных патологий плода (в два раза превышающему средний показатель по популяции) приводят концентрации HbA1c (первый триместр), которые обычно считаются «отличными» или «хорошими» – от 6,3 до 7%. При уровне HbA1c, равном 12,9%, риск врожденных патологий плода был в два раза выше, чем при HbA1c, равном 7%.
Таблица 3
Зависимость частоты возникновения врожденных пороков развития новорожденных от уровня HbA1c в крови женщин с СД в первом триместре беременности
|
Уровень HbA1c в крови женщин, больных СД, |
Количество новорожденных с врожденными |
|
<6,9 |
0 — 1 |
|
7 — 8,5 |
4 — 5 |
|
8,6–9,9 |
10 — 15 |
|
10 — 14 |
20 |
|
>14 |
40 |
В связи с этим возникает вопрос, какой уровень HbA1c является нормальным для беременных женщин. Ответ был получен в 2005 г., когда было показано, что у здоровых беременных женщин уровень HbA1c составляет 4,3–4,7%. Из этого следует весьма важная рекомендация: целью контроля гликемии у беременных женщин, страдающих СД I, должны быть концентрации HbA1c ниже 5% в первом триместре беременности и ниже 6% во втором триместре.
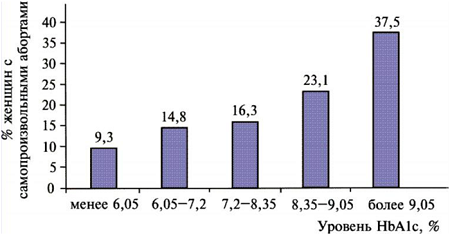
Рис. 10. Зависимость частоты самопроизвольных абортов в первом триместре беременности у женщин, больных СД, от уровня в крови HbA1c
В целом, определение НbА1с незаменимо для женщин, больных диабетом, как при планировании беременности, так и во время ее протекания. Установлено, что повышенный уровень НbА1с на протяжении 6 месяцев до зачатия и в течение I триместра беременности коррелирует с ее неблагоприятным исходом. Жесткий контроль за уровнем гликемии позволяет снизить частоту пороков развития плода с 30 — 40% до 2%.
HbA1c – ПРЕДИКТОР КОЛОРЕКТАЛЬНОГО РАКА
Становится все более очевидным, что нарушения метаболизма глюкозы связаны с риском возникновения рака прямой кишки. В течение 6 лет у 9 605 мужчин и женщин, страдавших диабетом, измеряли концентрации HbA1c. Обнаружилось, что повышение уровней HbA1c связано с постепенным повышением риска рака прямой кишки. Наименьший риск наблюдался при концентрации HbA1c ниже 5%, и затем показатели риска возрастали с ростом уровня HbA1c. Доказано, что диабеты повышают риск рака прямой кишки в три раза и что уровень HbA1c – количественный показатель этого риска. Итак, из всего сказанного следует, что снижение уровней HbA1c крайне важно не только для диагностики и правильной и объективно обоснованной терапии диабетов, но и для снижения риска их осложнений. В целом, измерение гликозилированного гемоглобина необходимо для:
- правильной диагностики диабетов,
- достоверно обоснованной терапии гипергликемии и мониторинга сахарного диабета; а также для оценки рисков:
- общей смертности;
- фатальных и нефатальных инфарктов миокарда;
- ишемических инсультов;
- диабетической ретинопатии;
- нефропатии;
- микроальбуминурии (строго говоря, микроальбуминурия – симптом нефропатии);
- нейропатии;
- врожденных патологий плода;
- колоректального рака.
HbA1c – НОРМА И ПАТОЛОГИЯ
Норма HbA1c – 4–6,5% от уровня общего гемоглобина. При этом уровень HbA1c, зависящий от концентрации глюкозы, может не зависеть от концентрации гемоглобина в крови. У больных СД уровень HbA1c может быть повышен в 2–3 раза. В соответствии с рекомендациями ВОЗ тест на HbA1c признан необходимым для контроля терапии сахарного диабета.
Больным сахарным диабетом рекомендуется проводить определение HbA1c не менее одного раза в квартал.
Уровень HbA1c в эритроцитах, как говорилось, – это интегральный показатель состояния углеводного обмена за предшествующие 6–8 недель. Для объективной оценки лечения целесообразно повторять измерение HbAlc через каждые 1,5–2 месяца. При контроле эффективности лечения СД рекомендуется поддерживать уровень HbA1c менее 7% и проводить коррекцию терапии при уровнях HbA1c более 8%. Как правило, нормализация уровня HbA1c в крови происходит на 4–6 неделе после достижения нормального уровня глюкозы. Клинические исследования с использованием сертифицированных методов показали, что повышение концентрации HbA1c на 1% связано с повышением среднего уровня глюкозы плазмы примерно на 2 ммоль/л.
У КОГО И КАК ЧАСТО НАДО ИЗМЕРЯТЬ УРОВЕНЬ HbA1c? СКРИНИНГ НА САХАРНЫЙ ДИАБЕТ
Комитет экспертов ВОЗ рекомендует проводить обследование на диабет следующих категорий граждан:
- всех пациентов в возрасте старше 45 лет (при отрицательном результате обследования повторять каждые 3 года);
- пациентов более молодого возраста при наличии: ожирения; наследственной отягощенности по сахарному диабету; этнической/расовой принадлежности к группе.
Отличновысокого риска; гестационного диабета в анамнезе; рождении ребенка весом более 4,5 кг; гипертонии; гиперлипидемии; выявленной ранее НТГ или высокой гликемии натощак. Для скрининга сахарного диабета ВОЗ рекомендует определение как уровня глюкозы, так и показателей гликозилированного гемоглобина HbА1с.
Важная информация
Результаты таких определений, сделанные в разных лабораториях, могут различаться в зависимости от применяемого метода, поэтому определение HbA1c в динамике лучше проводить в одной лаборатории или тем же методом.
Показания к назначению анализа
- Диагностика и скрининг сахарного диабета.
- Долговременный мониторинг течения и контроля за эффективностью лечения больных сахарным диабетом.
- Определение уровня компенсации сахарного диабета.
- Дополнение к глюкозотолерантному тесту при диагностике преддиабета и вялотекущего диабета.
- Обследование беременных женщин (скрытый диабет).
Подготовка к исследованию
Уровень HbA1c не зависит от времени суток, физических нагрузок, приема пищи, назначенных лекарств, эмоционального состояния пациента.
Материал для исследования – венозная кровь (1 мл), забираемая с антикоагулянтом (ЭДТА). Время суток не влияет на результат исследования. Единицы измерения в лаборатории – % от общего количества гемоглобина. Референсные значения: 4,5–6,5% от общего содержания гемоглобина.
Диагностические значения повышенных уровней HbA1с
1. Сахарный диабет и другие состояния с нарушенной толерантностью к глюкозе.
2. Определение уровня компенсации:
- 5,5 — 8% – хорошо компенсированный сахарный диабет;
- 8 — 10% – достаточно хорошо компенсированный сахарный диабет;
- 10 — 12% – частично компенсированный сахарный диабет;
- >12% – некомпенсированный сахарный диабет.
3. Дефицит железа.
4. Спленэктомия.
«Ложное повышение HbA1c» может быть обусловлено высокой концентрацией фетального гемоглобина HbFМ (гемоглобина новорожденных). Норма фетального гемоглобина в крови взрослого – до 1%. Улучшение регулирования глюкозы, осуществляемое в течение последних 4 недель перед забором крови, не отражается на результате.
Диагностические значения пониженных уровней HbA1с
Гипогликемия, гемолитическая анемия, кровотечения, переливание крови.
Ложно пониженные значения HbAlc имеют место при уремии, острых и хронических геморрагиях, а также при состояниях, связанных с уменьшением жизни эритроцитов (например, при гемолитической анемии).
Литература:
1. Pirart J. Diabetes mellitus and its degenerative complications: a prospective study of 4,400 patients observed between 1947 and 1973 (part 1)//Diabetes Care. 1978; 1: 168–188.
2. Klein R. Hyperglycemia and microvascular and macrovascular disease in diabetes //Diabetes Care. 1995. 18: 258–268.
3. Stratton I.M., Adler A.I., Neil H.A., Matthews D.R., Manley S.E., Cull C.A., Hadden D., Turner R.C., Holman R.R. Association of glycaemia with macrovascular and microvascular complications of type 2 diabetes (UKPDS 35): prospective observational study//BMJ. 2000. Aug 12; 321(7258): 405–412.
4. Krolewski A.S., Laffel L.M., Krolewski M., Quinn M., Warram J.H. Glycosylated hemoglobin and the risk of microalbuminuria in patients with insulin-dependent diabetes mellitus//N. Engl. J. Med. 1995. 332: 1251–1255.
5. DCCT Research Group. The absence of a glycemic threshold for the development of long-term complications: the perspective of the diabetes control and complications trial//Diabetes. 1996. 45: 1289–1298.
6. Orchard T., Forrest K., Ellis D., Becker D. Cumulative glycemic exposure and microvascular complications in insulin-dependent diabetes mellitus//Arch. Intern. Med. 1997. 157: 1851–1856.
7. Balkau B., Bertrais S., DucimitiЛre P., EschwЛge E. Is there a glycemic threshold for mortality risk?//Diabetes Care. 1999. 22: 696–699.
8. Coutinho M., Gerstein H.C., Wang Y., Yusuf S. The relationship between glucose and incident cardiovascular events: a metaregression analysis of published data from 20 studies of 95,783 individuals followed for 12,4 years//Diabetes Care. 1999. 22: 233–240.
9. Khaw K.T., Wareham N., Bingham S., Luben R., Welch A., Day N. Association of hemoglobin A1c with cardiovascular disease and mortality in adults: the European prospective investigation into cancer in Norfolk//Ann. Intern. Med. 2004. 141(6): 413–420.
10. Menon V., Greene T., Pereira A.A., Wang X., Beck G.J., Kusek J.W., Collins A.J., Levey A.S., Sarnak M.J. Glycosylated Hemoglobin and Mortality in Patients with Nondiabetic Chronic Kidney Disease//J. Am. Soc. Nephrol. 2005. 16: 3411–3417.
11. Nakanishi S., Yamada M., Hattori N., Suzuki G. Relationship between HbA(1)c and mortality in a Japanese population//Diabetologia. 2005. 48(2): 230–234.
12. Selvin E., Marinopoulos S., Berkenblit G., Rami T., Brancati F.L., Powe N.R., Golden S.H. Meta-analysis: Glycosylated hemoglobin and cardiovascular disease in diabetes mellitus//Ann. Intern. Med. 2004. 141(6): 421–431.
13. Selvin E., Coresh J., Golden S.H., Boland L.L., Brancati F.L., Steffes M.W. Atherosclerosis risk in communities study. Glycemic control, atherosclerosis, and risk factors for cardiovascular disease in individuals with diabetes: the atherosclerosis risk in communities study//Diabetes Care. 2005. 28(8): 1965–1973.
14. Selvin E., Coresh J., Golden S.H., Brancati F.L., Folsom A.R., Steffes M.W. Glycemic control and coronary heart disease risk in persons with and without diabetes: the atherosclerosis risk in communities study//Arch. Intern. Med. 2005. 165(16): 1910–1916.
15. Ravipati G., Aronow W.S., Ahn C., Sujata K., Saulle L.N., Weiss M.B. Association of hemoglobin A(1c) level with the severity of coronary artery disease in patients with diabetes mellitus//Am. J. Cardiol. 2006. 97(7): 968–969.
16. Терещенко С.Н., Джаиани Н.А., Голубев А.В. Ишемическая болезнь сердца и сахарный диабет//Consilium medicum. 2005. 7. No 5.
17. Collins .R, Armitage J., Parish S., Sleigh P., Peto R. MRC/BHF Heart Protection Study of cholesterol-lowering with simvastatin in 5963 people with diabetes: a randomised placebo controlled trial//Lancet. 2003. 361: 2005–2016.
18. Lyons T.J., Jenkins A.J. Lipoprotein glycation and its metabolic consequences //Curr. Opin. Lipidol. 1997. 8: 174–180.
19. Moro E., Alessandrini P., Zambon C., Pianetti S., Pais M., Cazzolato G., Bon G.B. Is glycation of low density lipoproteins in patients with type 2 diabetes mellitus a LDL pre-oxidative condition?//Diabet Med. 1999. 16: 663–669.
20. Witztum J.L., Mahoney E.M., Branks M.J., Fisher M., Elam R., Steinberg D. Nonenzymatic glucosylation of low-density lipoprotein alters its biologic activity//Diabetes. 1982. 31: 283–291.
21. Scheffer P.G., Teerlink T., Heine R.J. Clinical significance of the physicochemical properties of LDL in type 2 diabetes//Diabetologia. 2005. 48: 808.
22. Veiraiah A. Hyperglycemia, lipoprotein glycation, and vascular disease//Angiology. 2005. 56(4): 431–438.
23. Ostgren C.J., Lindblad U., Ranstam J., Melander A., Rastam L. Glycaemic control, disease duration and beta-cell function in patients with Type 2 diabetes in a Swedish community. Skaraborg Hypertension and Diabetes Project//Diabet Med. 2002. 19: 125–129.
24. Lehto S., Ronnemaa T., Pyorala K., Laakso M. Predictors of stroke in middle-aged patients with non-insulin-dependent diabetes//Stroke. 1996. 27: 63–68.
25. Kothari V., Stevens R.J., Adler A.I., Stratton I.M., Manley S.E., Neil H.A., Holman R.R. UKPDS 60: risk of stroke in type 2 diabetes estimated by the UK Prospective Diabetes Study risk engine//Stroke. 2002. 33(7): 1776–1781.
26. Stevens R.J., Coleman R.L., Adler A.I., Stratton I.M., Matthews D.R., Holman R.R. Risk factors for myocardial infarction case fatality and stroke case fatality in type 2 diabetes: UKPDS 66//Diabetes Care. 2004. 27(1): 201–207.
